中药学院胡凯莉团队设计精准靶向癌症相关成纤维细胞的纳米调节器增强三阴性乳腺癌化疗免疫疗法
发布时间:2025.10.05点击:10
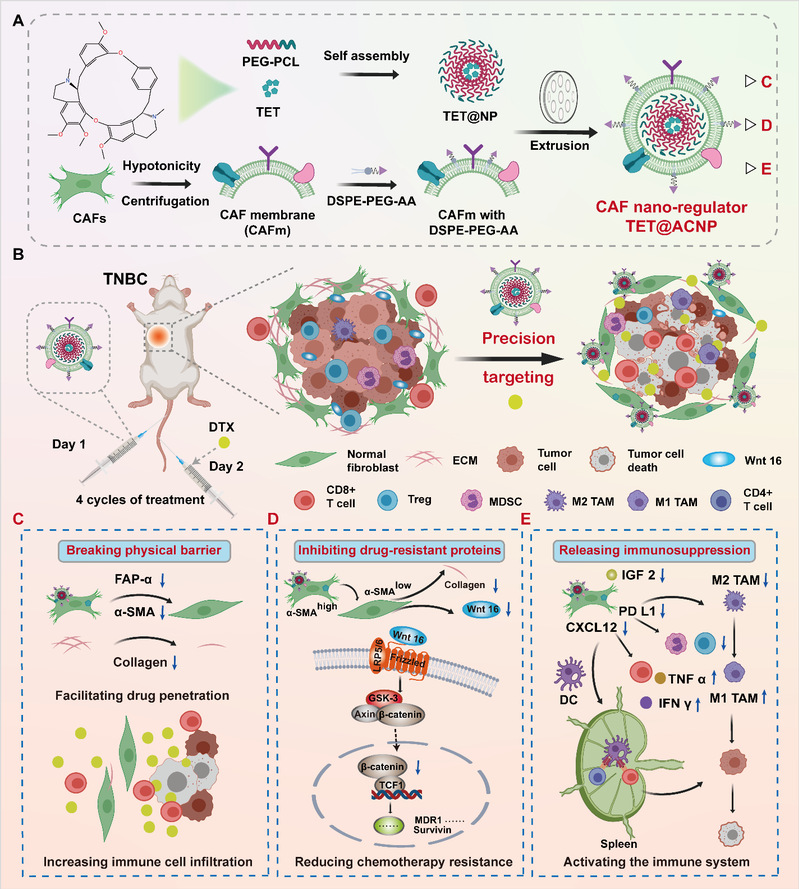
近日,我校中药学院胡凯莉团队通过结合癌症相关成纤维细胞(CAFs)细胞膜的同源靶向效应和茴香酰胺与sigma受体的高亲和作用,设计了精准靶向CAFs的纳米调节器(TET@ACNP),从打破基质物理屏障、克服多西他赛(DTX)耐药和增强抗肿瘤免疫等多方面实现了三阴性乳腺癌的综合治疗。研究成果Precision targeted cancer-associated fibroblast nano-regulator enhanced chemo-immunotherapy for triple-negative breast cancer发表在生物医学领域国际期刊Biomaterials。

三阴性乳腺癌(TNBC)是一种极具侵袭性的乳腺癌亚型,约占所有乳腺癌的15%至20%。化疗和免疫疗法的联合应用是临床治疗TNBC的有效选择。然而,TNBC 易对化疗产生耐药性,并存在免疫抑制微环境,这极大限制了化疗联合免疫疗法的效果。CAFs作为TNBC肿瘤微环境的主要组成部分,通过形成致密的基质物理屏障、诱导化疗耐药性并促进形成肿瘤免疫抑制性微环境,影响肿瘤生长并限制多种临床治疗手段的疗效。因此,基于靶向调控CAFs的治疗策略在TNBC治疗中具有广阔前景。然而,由于缺乏特异性标记物,精准靶向调控CAFs仍面临挑战。
中药活性成分汉防己碱具有多通路多靶点的作用特点,前期研究结果显示其在抑制CAFs活化,缓解CAFs引起的化疗耐药等方面具备显著优势。但汉防己碱水溶性较差,无CAF靶向性,限制了其进一步应用。研究通过结合CAF细胞膜的同源靶向效应和茴香酰胺与sigma受体的高亲和作用,将对CAF具有显著调控作用的中药活性成分汉防己碱负载其中,设计了精准靶向CAFs的纳米调节器(TET@ACNP),通过重编程CAFs增强DTX的化疗效果及抗TNBC免疫,实现了TNBC的综合治疗。一方面,TET@ACNP抑制活化CAFs的同时破坏了胶原蛋白等形成的基质物理屏障,为化疗药物和免疫细胞向肿瘤浸润铺平道路。另一方面,TET@ACNP通过抑制Wnt/β-catenin通路克服DTX耐药性,实现抗肿瘤增殖与转移效应。此外,TET@ACNP联合DTX可抑制免疫逃逸关键蛋白IGF2的表达,在增强抗肿瘤免疫的同时解除免疫抑制性微环境,为TNBC免疫治疗创造条件。总体而言,研究提出了精准靶向CAFs的新思路,解决了CAFs靶向困难的难题,为以CAFs为癌症治疗靶点的临床研究提供了参考。同时,该研究提出了基于精准靶向调控CAFs联合化疗的癌症综合治疗策略,这有望发展为通用治疗平台,提升各类富基质肿瘤中不同化疗药物的疗效。
中药学院硕士研究生先鹏和博士研究生邹灵辉为论文共同第一作者,胡凯莉研究员和交叉科学研究院倪淑婷实验师为论文通讯作者。我校为论文唯一通讯单位。研究工作得到上海市教育委员会“曙光计划”、上海市东方英才拔尖计划和上海中医药大学医养结合项目的资助。(科技处、中药学院)